疫苗是预防传染病和抗击癌症等领域最有效的工具之一。自18世纪末,爱德华·詹纳发明第一种疫苗以来,疫苗策略已经发生了演变,从活性病原体灭活或减毒技术到构建生物修饰蛋白或肽抗原,最终演变成利用核酸诱导体内抗原编码的方式。传统疫苗方法在控制传染病和癌症治疗方面取得了成功,但仍然面临一些挑战,因此对疫苗技术的突破势在必行。
近年来,环状RNA(circRNA)因其独特的结构和功能而备受关注,被认为可能是下一代疫苗的有力候选者。
为此,中山大学肿瘤防治中心邹宇田和郑少全在J Transl Int Med(IF=4.9)期刊上发表了一篇题为“Circular RNA: A promising new star of vaccine”的综述,讨论了circRNA作为疫苗的潜在优势,介绍了其生物学、分子生物学、合成方法、递送方式以及当前的circRNA疫苗研究。同时,还讨论了该领域面临的挑战及未来的发展方向。
01 circRNA概述
circRNA是许多后生动物(包括人类)转录组的显著特征,尽管曾被视为剪接错误的“废物”,但因其具有细胞特异性、组织特异性和发育阶段特异性等表达模式,成为新一代明星分子。
作为一类不具有5’和3’末端并以共价键形成闭环的单链RNA,功能上,circRNA参与多种生物学过程,包括细胞活动调控、细胞分化、组织稳态、疾病发展以及免疫代谢调节等。
近期研究表明,circRNA具有蛋白编码能力,使其成为潜在的疫苗候选者。又因其固有的稳定性、免疫原性、通过工程实现的高翻译效率,以及不需要核苷酸修饰,作者认为相较于mRNA,circRNA疫苗更具发展潜力。
02 circRNA疫苗的分子生物学
circRNA疫苗是核酸疫苗的一类,用于预防传染病和癌症治疗等疾病相关免疫治疗。其机制是在注射circRNA疫苗后通过翻译生成相应的蛋白质刺激免疫细胞的激活和增值来诱导和强化先天适应性免疫,增强机体对病毒和肿瘤的抵抗能力。例如,Yang等人报道了将编码四种细胞因子的circular mRNA(cmRNA)混合物直接注射到肿瘤中,可以导致T细胞(包括CD4+和CD8+T细胞)的激活,促进免疫细胞渗透到肿瘤中,产生强烈的抗肿瘤效果。有证据表明,细胞内免疫刺激RNA受体的激活可以固有地诱导免疫原性circRNA。由于其免疫原性,circRNAs可以作为自主佐剂的疫苗。例如,在由魏文胜等人领导的研究中,CircRNARBD疫苗触发了明显的Th1偏向的免疫反应,并在大部分患者中诱导了中和抗体产生,表明激活了免疫反应。
由于其独特的特性,circRNA疫苗优于传统疫苗。
首先,circRNA对比mRNA具有较高的翻译率,翻译产物的表达时间更长。
其次,circRNA即使数量适中,也能高度免疫原性地表达特定抗原以进行抗原呈递。
第三,与mRNA-LNP疫苗相比,circRNA表现出更高的热稳定性。
然而,circRNA疫苗的局限性和缺点仍不清楚,安全性问题需要进一步研究。
03 circRNA疫苗的合成与递送
文章中详细介绍了circRNA制备的方法,分为序列设计、前体线性RNA的合成、circRNA体外环化等步骤,合成策略包括化学合成、蛋白酶法合成、核酶环化合成。
circRNA的成功递送在疫苗中尤为重要。文献证明,常规的物理技术,如基因枪、电穿孔和微针,可提高裸mRNA抗原呈递的效果,暗示着相同的方法可以用于促进裸circRNA疫苗的给药。在所有mRNA递送载体中,基于LNP递送系统效率最高且占据主导地位,它的优势包括生物相容性、易形成、模块化和大量载荷容量。为提高其效率,circRNA通常通过LNP进行给药。例如,将封装在LNPs中的纯化的hEpo circRNAs注射到293细胞中,表现出稳健的表达能力,证明了通过LNP递送circRNA的潜力。
04 当前的circRNA疫苗
病毒性传染病
CircRNARBD:编码SARS-CoV-2受体结合结构域(RBD)的circRNA疫苗
魏文胜团队在这项研究中合成了一种编码SARS-CoV-2 RBD抗原的circRNA疫苗,小鼠(6-8周龄的雌性BALB/c小鼠)和恒河猴(2-4岁的雄性)有效产生足够的中和抗体和强有力的针对SARS-CoV-2的特异性T细胞应答。此外,与mRNA疫苗相比,这种circRNA疫苗诱导了更多、更持久的免疫原,引发了对SARS-CoV-2及其新变种(如Omicron和Delta)的更大中位数的保护性抗体比例和Th1偏向的免疫反应。此外,该研究证明,circRNARBD-Delta疫苗可以对所有其他变种,包括Omicron,提供交叉保护,并且在两剂初始SARS-CoV-2疫苗后可以作为有效的增强剂。编码SARS-CoV-2特异性中和纳米体和hACE2诱饵的circRNAs也被测试其治疗潜力,并且在中和SARS-CoV-2擬病毒方面表现出效果。此外,在接种的非人灵长类动物中,circRNA疫苗没有引起生病或加重病理学病变的临床迹象,这可能是其安全性的证明。
VFLIP-X:一种针对SARS-CoV-2的circRNA疫苗
在这项研究中,开发了一种名为VFLIP-X的circRNA疫苗,以测试其作为新一代COVID-19疫苗的潜力。为了测试该疫苗的有效性,研究使用了7周龄的雌性BALB/C小鼠。VFLIP是通过在S2亚基中使用一个灵活的S1/S2链接器,替换S2亚基中的五个脯氨酸,并进行两个半胱氨酸替代以诱导分子间二硫键形成而工程设计的螺旋蛋白。VFLIP-X包含六个合理替代的氨基酸,这些氨基酸是基于在所有SARS-CoV-2变体中发现的共突变(D614G)和在多个引起关注的变体和感兴趣变体中共同鉴定的五个突变(E484K、K417N、L452R、N501Y和T478K)而理性选择的。circRNAs是通过基于T7 RNA聚合酶的体外转录制备的,并封装在LNPs中。研究表明,VFLIP-X赋予对SARS-CoV-2的中和作用,刺激产生针对SARS-CoV-2变体的交叉中和抗体,并激活针对B.1.1.529变体的体液和细胞免疫反应。该研究确定了一种编码相对稳定的VFLIP-X螺旋蛋白免疫原的SARS-CoV-2 circRNA疫苗,将适用作为下一代COVID-19疫苗,防范已有和正在发展的SARS-CoV-2变体。
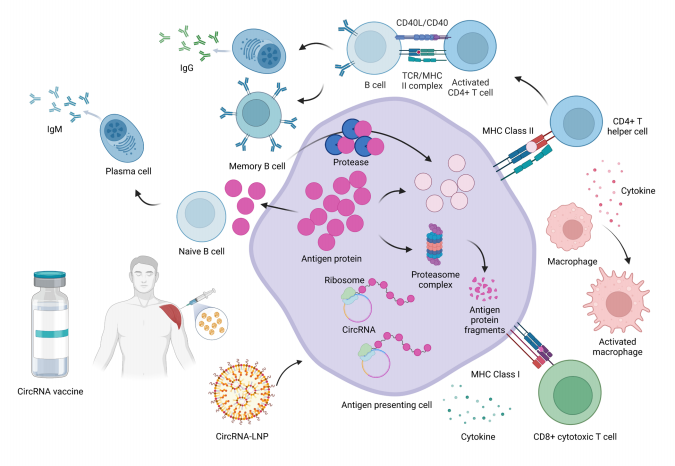 图 1:circRNA体内传递与免疫激活
图 1:circRNA体内传递与免疫激活肿瘤免疫治疗
编码癌症治疗的细胞因子的circRNA
在这项研究中,由PIE制备的circRNA利用新型spacer1和E29 IRES来引导蛋白质翻译,并封装在LNPs中。这种类型的circRNA比mRNA更有弹性,可以介导比mRNA更多的蛋白质产生。用于体外和体内实验的分别是肿瘤细胞和小鼠模型。体外和体内实验证实了其有效表达各种蛋白质的能力,表明其可作为通用的蛋白质表达载体。注射编码四种细胞因子的cmRNA复合物可诱导显著的抑制肿瘤效应。它激活免疫细胞,尤其是T细胞,并与抗PD-1抗体合作,促进总的免疫细胞渗透到肿瘤中,产生强烈的抗肿瘤效果。这些结果表明,这种新型的裸cmRNA具有作为各种肿瘤局部治疗RNA平台的潜力。
CircRNAOVA-luc-LNP疫苗
circRNAOVA-luc-LNP(OVA[257-264]-luciferase-coding-circRNA)疫苗,建立了三个小鼠肿瘤模型来评估疫苗的有效性。circRNA-LNPs引发了强有力的先天免疫反应和显著的抗原特异性反应。这种circRNA-LNP疫苗在抑制免疫亲和性肿瘤的发展、诱导免疫荒漠肿瘤的完全肿瘤消退以及预防癌细胞转移方面显示出巨大的功效。此外,circRNA-LNPs可以与过继性细胞转移疗法合作,通过增强TCR-T细胞的持久性,完全抑制晚期免疫亲和性肿瘤的进展,展示了RNA疫苗作为肿瘤治疗的潜力。
如表1所示,circRNA疫苗的特征,包括其高稳定性、在蛋白质表达方面的高效性、稳定且持久的表达产物以及启动免疫反应的能力,是它成为上述疫苗的有潜力替代品的原因。此外,circRNA疫苗优于mRNA疫苗。其制备程序和保存条件简单经济,更适合大规模生产和广泛应用。
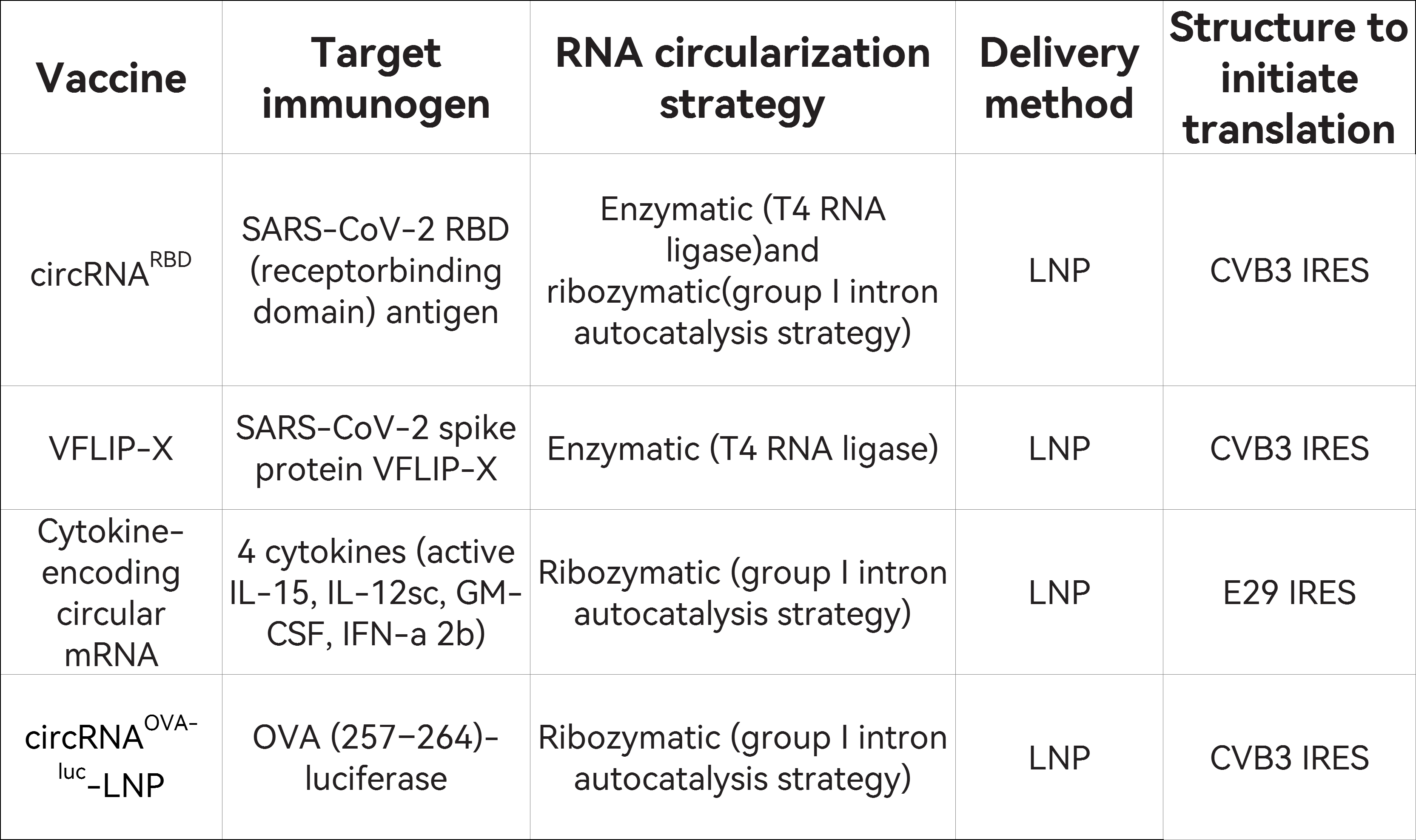 表1: 新型circRNA疫苗的比较
表1: 新型circRNA疫苗的比较结论
由于circRNA具有很多优点,如高稳定性和可实现的高翻译效率,可用作疫苗。然而,在其广泛应用之前,需要进行更多的研究和改进。随着未来技术的进步,我们可以预见circRNA疫苗在预防传染病和抑制肿瘤恶性肿瘤方面将得到广泛应用,并进入临床试验。
.png)
